
Zatrucie jadem kiełbasianym u bydła – cykl: „Weterynaria w Nauce i Praktyce XXI Wieku” cz. 2

Zatrucie jadem kiełbasianym u bydła
– objawy kliniczne, diagnostyka i leczenie
Objawy kliniczne
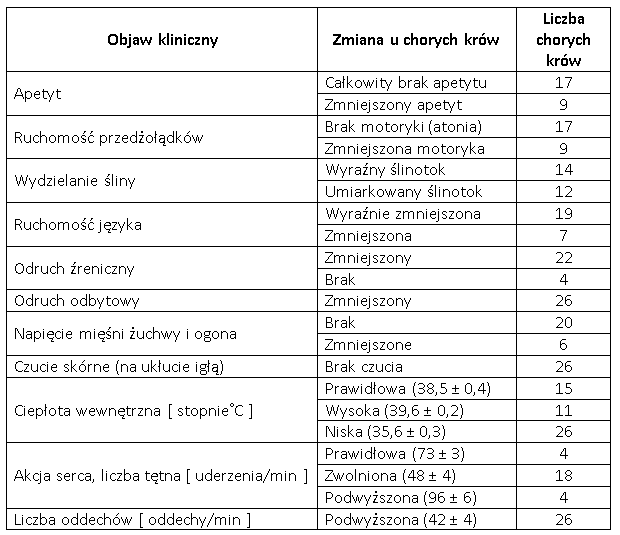
Okres inkubacji choroby wynosi od 6 godz. i nawet do 17 dni. Okres inkubacji choroby jest uzależniony od ilości spożytej neurotoksyny i od wrażliwości osobniczej zwierząt. Choroba przebiega głównie z objawami porażenia wiotkiego mięśni szkieletowych. W początkowym okresie choroby porażenie obejmuje mięśnie głowy, a następnie tułów i kończyny. Zwierzęta nie są w stanie utrzymać pozycji stojącej, kładą się na mostku lub w końcowej fazie choroby na boku. Pojawia się ogólne osłabienie, bezgorączkowy przebieg, ataksja, ślinotok, brak apetytu i pragnienia, opadanie uszu, brak odruchu rogówkowego początkowa wodnista biegunka zmienia się w twardy, zbity kał. Wskutek braku brak napięcia języka powoduje że język wyciągnięty z jamy ustnej samoistnie nie powraca. Chorobie towarzyszy odwodnienie, brak przeżuwania, występuje atonia lub hipotonia żwacza, zwiotczenie ogona, brak czucia powierzchownego skóry oraz brzuszny typ oddychania brzuszny. Porażenie wiotkie przepony lub niewydolność mięśnia sercowego może doprowadzić do zejścia śmiertelnego Własne obserwacje wykazały ostry przebieg oraz dużą śmiertelność u jałówek wieku 10 – 12 miesięcy i krów zasuszonych. Straty ekonomiczne wynikają z dużej śmiertelności choroby i braku leczenia przyczynowego. Śmiertelność u bydła może być różna od 8% do 64%, ale najczęściej waha się w granicach 30–45%. Najważniejsze objawy kliniczne zatrucia jadem kiełbasianym występujące w stadzie 26 krów zostały przedstawione w Tab. 2
Tab. 2. Objawy zatrucia jadem kiełbasianym oparte na badaniu klinicznym u 26 sztuk chorego bydła [Senturk and Cihan 2007]
Diagnostyka botulizmu u bydła
Zmiany w obrazie hematologicznym i biochemicznym krwi są w dużym stopniu uzależnione od ilości spożytej toksyny, rodzaju toksyny, czasu od momentu spożycia toksyny i od wrażliwości osobniczej zwierząt. Na wyniki badań krwi mają wpływ objawy kliniczne w postaci braku apetytu i pragnienia, braku perystaltyki przedżołądków i jelit, porażenia wiotkiego oraz zalegania. Zmiany w wynikach badań laboratoryjnych wynikają z zagęszczenia krwi, uszkodzenia z nieczynności mięśni szkieletowych, rozwijającej się kwasicy metabolicznej i mogą być pomocne w leczeniu chorych zwierząt. Zmiany w wynikach badań laboratoryjnych nie są jednorodne i nie mogą być podstawą do postawienia właściwej diagnozy. Dwa parametry w zatruciu jadem kiełbasianym są stale podwyższone, a mianowicie aktywność AST i CPK. AST uważany jest za enzym nieswoisty dla narządów, jest czuły wskaźnikiem uszkodzenia wątroby, mięśni poprzecznie prążkowanych i serca, natomiast CPK jest swoistym enzymem dla mięśni poprzecznie prążkowanych. Podwyższona aktywność obu enzymów w powiązaniu z zaleganiem zwierząt przemawia za uszkodzeniem mięśni szkieletowych, na tle nieczynności powodowanych toksyną. Wykonanie badań hematologicznych i biochemicznych pozwala na wykluczenie innych chorób oraz umożliwia korektę istniejących zaburzeń ustrojowych w przebiegu leczenia.
W diagnostyce botulizmu jedyną zatwierdzoną metodą wykrywania neurotoksyny botulinowej jest próba biologiczna na myszach (mouse bioassay – MBA). Próba ta polega na dootrzewnowym podaniu zwierzętom ekstraktu z podejrzanej próbki lub supernatantu z hodowli szczepu podejrzanego o produkcję neurotoksyny. Potwierdzeniem obecności neurotoksyny botulinowej w próbce jest wystąpienie objawów botulizmu u myszy po 48 godz. od iniekcji. (Kukier i wsp. 2015)

Rozpoznanie różnicowe
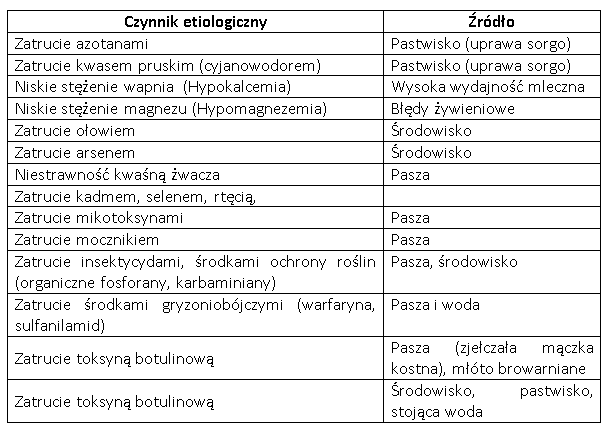
Rozpoznanie botulizmu jest w wielu przypadkach bardzo trudne. Trudności te są wynikiem następujących faktów: bardzo ciężko jest wykryć niewielkie stężenie toksyny botulinowej, często nie udaje się wykryć toksyny w paszy, stosowane metody analityczne są niewystarczająco czułe, a toksyna botulinowa w dostarczonych próbkach ulega szybkiej degradacji. W każdym przypadku masowego zachorowania zwierząt w pierwszej kolejności należy wykonać badanie toksykologicznym aby wykluczyć zatrucie związkami chemicznymi (związki fosforoorganiczne, karbaminiany, inne środki ochrony roślin). Przy wystąpieniu zalegania należy wykluczyć niestrawność kwaśną żwacza, niedobory mineralne takie jak: hypokalcemię, hypofosfatemię i hypomagnezemię (Rulff i wsp. 2015). Najczęściej choroby te związane są wysoką wydajnością mleczną i najczęściej dotyczą pojedynczych przypadków. W tabeli 3 zostały przedstawione najczęstsze przyczyny masowych zatruć i upadków u bydła.
Biorąc pod uwagę fakt, że laseczka Clostridium botulinum jest mikroorganizmem bytującym w przewodzie pokarmowym przeżuwaczy, jego izolacja z treści przewodu pokarmowego może jedynie sugerować ale nie przesądzać o rozpoznaniu. Dopiero izolacja toksyny botulinowej z badanego materiału potwierdza właściwe rozpoznanie. Materiałem badawczym może być treść przewodu pokarmowego, wycinki narządów wewnętrznych, surowica krwi oraz próbki paszy lub wody. Wyniki badania należy powiązać z zaznaczonymi objawami klinicznymi oraz z wykluczeniem innych możliwych przyczyn masowego zatrucia. W wielu przypadkach jednak nie udaje się wykryć źródła zatrucia jadem kiełbasianym
Tab. 3. Wykaz możliwych przyczyn masowych zachorowań i padnięć u bydła mlecznego.
Leczenie zatrucia
Leczenie zwierząt z objawami zatrucia jadem kiełbasianym jest bardzo trudne. Trudności w leczeniu wynikają z masowego zachorowania zwierząt, braku dostępności do surowicy i szczepionek oraz braku leczenia przyczynowego. Idealnym rozwiązaniem we wczesnej terapii zatrucia jadem kiełbasianym jest jak najwcześniejsze, natychmiastowe podanie podejrzanym o chorobę zwierzętom preparatów zawierających poliwalentne antytoksyny. Antytoksyna neutralizuje toksyny botulinowe obecne we krwi zanim one dotrą do zakończeń nerwowych i doprowadzą do depolaryzacji płytki nerwowo-mięśniowej. Jednak podanie antytoksyny staje się nieskuteczne w przypadku pojawienia się objawów klinicznych (Galey i wsp. 2000). W momencie wybuchu ogniska zatrucia zalecane są szczepienia interwencyjne. Niestety na krajowym rynku brak jest zarejestrowanych / dostępnych preparatów do profilaktyki i leczenia zatrucia u bydła (preparat z antytoksyną, szczepionki przeciw botulizmie). Praktycznie pozostaje jedynie leczenie wspomagające / objawowe obejmujące min. nawadnianie doustne i pozajelitowe, podawanie preparatów mineralno – witaminowych, niesteroidowych leków przeciwzapalnych, preparatów z węglem aktywnym i probiotyków, drożdży Saccharomyces cerviciae (Pandian i wsp. 2015). W leczeniu zatrucia jadem kiełbasianym nie należy stosować leków bakteriobójczych /bakteriostatycznych przeciw laseczkom Clostidium botulinum. Podanie tych leków może doprowadzić do lizy bakterii, uwolnienia do chorego organizmu większych ilości neurotoksyn i pogorszenia stanu ogólnego zwierzęcia. Podawanie antybiotyków należy ograniczyć do przypadków botulizmu przyrannego oraz powikłań botulizmu w postaci zachłystowego zapalenia płuc. W pracy Pandian i wsp. 2015 opisano wyleczenie 17 krów wybranych ze stada 74 chorych zwierząt. Autorzy do leczenia botulizmu u bydła wprowadzili podaż witamin AD3E, węgla aktywnego, probiotyku i preparatu zawierającego mikroelementy, natomiast nie polecają do leczenia antybiotyków, płynów i preparatów wapniowych podawanych dożylnie.

Profilaktyka zatrucia
Szczepienia zwierząt wydają się jedyną skuteczną bronią w profilaktyce botulizmu. W krajach o wysokiej zachorowalności na botulizm, szczególnie w ciepłym klimacie, powszechnie stosuje się szczepienia ochronne całego stada bydła mlecznego (Kukier i wsp. 2017) Szczepienia są zalecane w stadach bydła, gdzie w żywieniu krów mlecznych stosuje się duże ilości młóta browarnianego. Biorąc pod uwagę, że głównym źródłem zatrucia jadem kiełbasianym u zwierząt jest pasza należy zwrócić szczególną uwagę na właściwe przygotowanie i przechowywanie pasz dla bydła. Należy ograniczyć do minimum możliwość zanieczyszczenia paszy dla bydła materiałem biologicznym w postaci martwych zwierząt lub ptaków (Relum i wsp. 2017). Należy wyeliminować jakikolwiek kontakt (obsługa, maszyny i narzędzia) z obornikiem drobiowym, który może być zanieczyszczony bakteriami produkującymi toksyny lub samymi neurotoksynami. Obornik z ferm drobiu nie może być wykorzystany do poprawy żyzności łąk lub gleb przygotowanych do uprawy roślin przeznaczonych na paszę dla bydła. Należy również dbać o usuwanie z otoczenia i utylizację martwych drobnych zwierząt, które przypadkowo mogą się znaleźć w paszy przeznaczonej dla bydła. Należy zwrócić szczególną uwagę na jakość zakiszanych pasz objętościowych oraz sam proces zakiszania. W przypadku korzystania krów z pastwiska przed rozpoczęciem okresu wypasu należy usunąć z nich wszelkie martwe zwierzęta.
Marczuk Jan
Zakład Chorób Wewnętrznych Zwierząt Gospodarskich i Koni
Katedra i Klinika Chorób Wewnętrznych Zwierząt
Wydział Medycyny Weterynaryjnej
Uniwersytet Przyrodniczy w Lublinie
20-612 Lublin, ul. Głęboka 30
Uniwersytet Przyrodniczy w Lublinie
ul. Akademicka 13, 20-950 Lublin
NIP 712 010 37 75
REGON 000001896
e-Doręczenia: AE:PL-92700-40162-VCRBJ-25
ePUAP: /UP-Lublin/SkrytkaESP
