
Możliwość wykorzystania mikroorganizmów do usuwania zanieczyszczeń środowiska. Cykl: „Nauki Rolnicze XXI Wieku”.
Wraz ze wzrostem rozwoju przemysłu, głownie tekstylnego oraz farmaceutycznego do środowiska przedostają się różne zanieczyszczenia, tzw. ksenobiotyki. Są ta przede wszystkim barwniki syntetyczne, rozpuszczalniki organiczne oraz leki. Nie tylko przemysł jest źródłem zanieczyszczeń środowiska, także ścieki komunalne zawierają niebezpieczne substancje, które w środowisku zakłócają procesy przeprowadzane przez mikroorganizmy oraz wpływają niekorzystnie na wzrost roślin [1,2,3].
Jednym ze sposobów usuwania substancji niebezpiecznych ze środowiska jest bioremediacja. Biomeremediacja to proces oczyszczania środowiska który wykorzystuje naturalne właściwości mikroorganizmów. Ważne jest, że niektóre mikroorganizmy w zanieczyszczonych środowiskach, potrafią dostosować się do obecności ksenobiotyków i z czasem zaczynają je rozkładać wykorzystując do wzrostu [4]. Można więc zadać pytanie, w jaki sposób grzyby radzą sobie z zanieczyszczeniami środowiska? Grzyby, jak wszystkie mikroorganizmy do wzrostu potrzebują przede wszystkim substancji, które stanowią dla nich łatwo przyswajalne źródło węgla np. glukozę, ale mogą także pozyskiwać te związki ze złożonych polimerów np. ligniny i celulozy, które są składnikami ściany komórkowej roślin. Lignina ma skomplikowaną budowę, min. jest zbudowana z podjednostek aromatycznych. Grzyby potrafią jednak sforsować barierę jaka jest lignina za pomocą enzymów, które pomagają w rozkładzie jej podjednostek aromatycznych. Ze względu na fakt, że enzymy te mogą także rozkładać inne związki o podobnej do ligniny budowie, czyli inne związki aromatyczne, z powodzeniem są wykorzystywane do usuwania różnych zanieczyszczeń środowiska np. barwników czy leków [5].
Jeżeli w środowisku występują mikroorganizmy, których właściwości możemy wykorzystać do usuwaniu różnych zanieczyszczeń, warto zastanowić się czy ich wyodrębnienie ze środowiska jest możliwe? Otóż okazuje się, że tak, ale proces ich izolacji, identyfikacji i charakterystyki jest czasochłonny. Warto także wspomnieć, że rozkład ksenobiotyków w hodowlach mikroorganizmów w warunkach laboratoryjnych, w zależności od substancji oraz jej stężenia zajmuje nawet 2-3 tygodnie [Fot.1], co w porównaniu z metodami fizycznymi i chemicznymi, nie jest obiecującym rozwiązaniem.
Jeżeli jednak, uda się zoptymalizować warunki i parametry wzrostu mikroorganizmów tj. dobrać odpowiednią metodę hodowli, źródło i stężenie węgla i azotu, temperaturę i pH, można skrócić ten proces do 7 dni [6]. Co więcej, można wykorzystać enzymy wytwarzane przez mikroorganizmy, wówczas, czas usuwania zanieczyszczeń można skrócić nawet do 24-72 godzin [7, Fot. 2]. Jedna z najczęściej stosowanych metod w celu zwiększania skuteczności usuwania ksenobiotyków zarówno w hodowlach mikroorganizmów jak i przy użyciu enzymów jest unieruchomienie tzn. „kapsułkowanie” w półprzepuszczalnej membranie [Fot.2].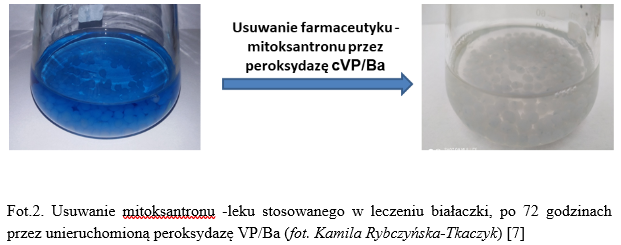
Przykładem mikroorganizmu, który został scharakteryzowany pod względem usuwania wielu różnych ksenobiotyków tj. barwników syntetycznych stosowanych w przemyśle tekstylnym oraz farmaceutyków (cytostatyków stosowanych w leczeniu białaczki) jest szczep grzyba Bjerkandera adusta CCBAS930 [1,2,3], a wytwarzany przez niego enzym, peroksydaza uniwersalna VP/Ba wydajnie usuwa wspomniane ksenobiotyki już po 1 godzinie [8].
Podsumowując należy podkreślić, że mikroorganizmy występujące w środowisku naturalnym charakteryzują się bardzo dużym potencjałem do usuwania niebezpiecznych zanieczyszczeń środowiska. Jeżeli z puli mikroorganizmów, uda się wyodrębnić taki szczep, który będzie odznaczał się na tle innych swoimi właściwościami do usuwania zanieczyszczeń środowiska, może być wykorzystany w biologicznych metodach oczyszczania np. ścieków przemysłowych.
Dr hab. Kamila Rybczyńska-Tkaczyk
Katedra Mikrobiologii Środowiskowej
Wydział Agrobioinżynierii
Bibliografia:
-
Korniłłowicz-Kowalska T., Rybczyńska K. Decolorization of Remazol Brilliant Blue R (RBBR) and Poly R-478 dyes by Bjerkandera adusta CCBAS 930. Central European Journal of Biology, 7(5), 948-956, https://doi.org/10.2478/s11535-012-0076-6
-
Rybczyńska-Tkaczyk K., Korniłłowicz-Kowalska T, Szychowki K.A., Gmiński J. 2020. Biotransformation and toxicity effect of monoanthraquinone dyes during Bjerkandera adusta CCBAS 930 cultures. Ecotoxicology and Environmental Safety, 191, 110203, https://doi.org/1016/j.ecoenv.2020.110203
-
Rybczyńska-Tkaczyk K., Korniłłowicz-Kowalska T., Szychowski K.A. 2021. Possibility to biotransform anthracyclines by peroxidases produced by Bjerkandera adustaCCBAS 930 with reduction of geno- and cytotoxicity and pro-oxidative activity. Molecules, 26(2), 462; https://doi.org/10.3390/molecules26020462
-
Waraczewska Z., Niewiadomska A., Grzyb A. 2018. Wybrane metody bioremediacji in situ z wykorzystaniem mikroorganizmów. Woda-Środowisko-Obszary Wiejskie.T. 18. Z. 3 (63) s. 65–78.
-
Kołwzan B., Adamiak W., Dziubek A.M. 2018. Możliwości zastosowania grzybów w technologiach oczyszczania i remediacji wybranych elementów środowiska. Ochrona Środowiska, 40 (1), 3-20.
-
Rybczyńska-Tkaczyk K. Enhanced efficiency of the removal of cytostatic anthracycline drugs using immobilized mycelium of Bjerkandera adustaCCBAS 930. Molecules. 26(22):6842. https://doi.org/10.3390/molecules26226842
-
Rybczyńska-Tkaczyk K. Bioremoval and detoxification of the anticancer drug mitoxantrone using immobilized crude versatile peroxidase (icVP/Ba) Bjerkandera adusta CCBAS 930. Biology, 11, 1553. https://doi.org/10.3390/biology11111553
-
Rybczyńska-Tkaczyk K. Characteristics of new anthraquinone derivative-degrading versatile peroxidase produced by Bjerkandera adusta CCBAS 930. International Biodeterioration and Biodegradation, 174, 105466, doi.org/10.1016/j.ibiod.2022.105466
dr hab. inż. Kamila Rybczyńska-Tkaczyk
Katedra Mikrobiologii Środowiskowej
Uniwersytet Przyrodniczy w Lublinie
ul. Akademicka 13, 20-950 Lublin
NIP 712 010 37 75
REGON 000001896
e-Doręczenia: AE:PL-92700-40162-VCRBJ-25
ePUAP: /UP-Lublin/SkrytkaESP
