
Koksyby w terapii przeciwzapalnej małych przeżuwaczy – cykl: „Weterynaria w Nauce i Praktyce XXI Wieku”
W dobie rosnącej troski o dobrostan zwierząt oraz potrzeby minimalizowania działań niepożądanych leków, szczególnie w intensywnych systemach produkcji, koksyby – selektywne inhibitory COX-2 należące do trzeciej generacji niesteroidowych leków przeciwzapalnych – zyskują coraz większe znaczenie w weterynarii. Artykuł prezentuje wyniki badań farmakokinetycznych prowadzonych przez naukowców Wydziału Medycyny Weterynaryjnej, wskazując na potencjał wymienionych leków w bezpieczniejszym i skuteczniejszym leczeniu bólu oraz stanów zapalnych u owiec i kóz.

Koksyby – 3 generacja niesteroidowych leków przeciwzapalnych
Niesteroidowe leki przeciwzapalne (NLPZ) są stosowane w leczeniu bólu, gorączki i stanów zapalnych w różnych chorobach. Chociaż właściwości NLPZ mogą się nieznacznie różnić między klasami i generacjami tych leków, ich główny mechanizm działania polega na hamowaniu cyklooksygenazy (COX) w różnych narządach. COX to enzym przekształcający kwas arachidonowy (AA) w prostanoidy, będące istotnymi mediatorami biologicznymi, takimi jak prostaglandyny (PG) i tromboksany (TX). W 1990 roku, dwie dekady po odkryciu COX, wykazano, że enzym ten występuje w dwóch izoformach: COX-1 i COX-2. W skrócie, COX-1 to enzym konstytutywny obecny w wielu narządach w warunkach fizjologicznych, natomiast COX-2 jest enzymem indukowanym w trakcie procesów zapalnych. Dodatkowo, w 2002 roku odkryto trzecią izoformę – COX-3, jednak jej znaczenie kliniczne nadal nie zostało w pełni poznane.
Ogólnie uważa się, że COX-1 odgrywa korzystną rolę w utrzymaniu homeostazy organizmu, m.in. w utrzymaniu integralności nabłonka śluzówki, dlatego jego zahamowanie może prowadzić do powstawania wrzodów żołądka. Selektywne hamowanie COX-2 może natomiast zmniejszyć produkcję prostanoidów takich jak PGE2 i PGI2, które biorą udział głównie w procesach zapalnych i patologicznych, a także zmniejszyć odczuwanie bólu. Z tego względu wiele badań klinicznych z użyciem NLPZ skupia się na selektywnym hamowaniu enzymu COX-2, co pozwala na ograniczenie działań niepożądanych wynikających z blokowania COX-1.
Koksyby to podklasa NLPZ charakteryzująca się obniżonym blokowaniem COX-1. Centrum aktywne COX-1 jest mniejsze niż w przypadku COX-2. Objętościowa struktura koksybów ogranicza ich zdolność do hamowania COX-1, natomiast pozwala na pełne zahamowanie szlaku COX-2. Klasyfikacja NLPZ uwzględnia selektywność wobec COX-2, określając leki jako: selektywne, specyficzne lub preferencyjne względem COX-2. Selektywność ta oceniana jest na podstawie stosunku wartości IC50 (stężenie hamujące o 50%) dla COX-1 do COX-2.
W medycynie ludzkiej wprowadzono kilka koksybów. Pierwsze były rofekoksyb i celekoksyb, zaliczane do generacji pierwszej. Nowsze substancje czynne, takie jak waldekoksyb, parekoksyb, etorikoksyb i lumirakoksyb, sklasyfikowano jako drugą generację – cechującą się większą selektywnością względem COX-2. W weterynarii wprowadzono: derakoksyb (2002), firokoksyb (2007), mawakoksyb (2008), robenakoksyb (2009) natomiast w 2011 roku cimicoksyb, który również trafił na rynek weterynaryjny, choć wcześniej stosowany był w medycynie ludzkiej (Emmerich, 2012). Ostatnie zarejestrowane do medycyny ludzkiej to witakoksyb (2016) oraz enflikoksyb (2021).
Stosowanie koksybów u małych przeżuwaczy
Obecnie rośnie zainteresowanie dobrostanem zwierząt. Tendencje te stanowią impuls do opracowywania skuteczniejszych i nowatorskich terapii weterynaryjnych. Mając na uwadze główne ograniczenie stosowania leków przeciwbólowych należących do NLPZ jakim jest duże prawdopodobieństwo wystąpienia nadżerek górnego odcinka przewodu pokarmowego w terapii bólu zwłaszcza długoterminowej, wybór selektywnych inhibitorów COX-2 wydaje się być priorytetem zwłaszcza u gatunków szczególnie narażonych na powstawanie takich zmian.
W nowoczesnych, intensywnych systemach chowu zwierząt istnieje ogromna presja, by maksymalizować produkcję mięsa lub mleka w celu zaspokojenia popytu rynkowego przy jednoczesnym osiągnięciu optymalnej rentowności. Jednak stosowanie diet o wysokiej zawartości skrobi, mających zaspokajać potrzeby metaboliczne zwierząt, może zwiększać podatność na zaburzenia żołądkowo-jelitowe. Wśród tych schorzeń szczególnie niepokojące są wrzody trawieńca, ponieważ mogą one znacząco wpływać na zdrowie i wydajność zwierząt.
Owrzodzenia trawieńca definiowane są jako lokalny proces autotrawienia śluzówki. Jednakże etiologia jest nadal niejasna. Prawdopodobnie rozwija się pod wpływem kwaśnej aktywności peptycznej lub jest wynikiem warunków fizjologicznych, w których śluzówka nie może przeciwstawić się destrukcyjnemu działaniu soku żołądkowego, ponieważ równowaga między procesami ochronnymi i destrukcyjnymi jest zaburzona.
Zmiany te wynikają z zaburzenia równowagi między mechanizmami obronnymi błony śluzowej trawieńca a działaniem czynników uszkadzających, takich jak urazy mechaniczne (obecność czynników ściernych, takich jak błonnik, geoosady i trichobezoary), nadkwaśność związana z dietą bogatą w łatwo przyswajalne węglowodany, stres, zaburzenia mikrobiologiczne w przewodzie pokarmowym (przerost flory bakteryjnej) oraz stosowanie niesteroidowych leków przeciwzapalnych. Ponadto do czynników sprzyjających powstawaniu wrzodów zalicza się wiek, warunki atmosferyczne, system utrzymania a także niedobory minerałów.
Jednakże różnice międzygatunkowe, takie jak wrażliwość i farmakokinetyka leków, mogą prowadzić do nieprzewidzianych efektów, jeśli leki te stosowane są bez zrozumienia ich działania u docelowego gatunku. Przeżuwacze mogą być bowiem bardziej wrażliwe na koksyby niż inne gatunki z powodu różnic w metabolizmie, wchłanianiu i krążeniu wątrobowo-jelitowym.

Ryc. 2 Przeżuwacze mogą być bardziej wrażliwe na koksyby niż inne gatunki. (zdj. Beata Łebkowska-Wieruszewska)
Z tych powodów znajomość właściwości farmakologicznych, farmakokinetycznych/farmakodynamicznych (losy leków od wchłaniania do wydalania) oraz profilu bezpieczeństwa każdego leku jest kluczowa dla prawidłowego stosowania koksybów w weterynarii.
Zastosowanie derakoksybu i robenakoksybu u małych przeżuwaczy z punktu widzenia farmakokinetyki
Derakoksyb był pierwszym przedstawicielem selektywnych inhibitorów COX-2 zatwierdzonym do stosowania w medycynie weterynaryjnej. Został wprowadzony do terapii psów w 2002 roku jako nowoczesna alternatywa dla klasycznych NLPZ, których działanie niepożądane – szczególnie w zakresie przewodu pokarmowego i nerek – stanowiło istotne ograniczenie ich stosowania.
Derakoksyb należy do grupy diarilowych heterocykli i wykazuje czasowo zależne, pseudo-nieodwracalne hamowanie izoenzymu COX-2, co przekłada się na jego przeciwzapalne, przeciwbólowe i przeciwgorączkowe właściwości. Wprowadzenie tego leku do praktyki weterynaryjnej otworzyło nowy rozdział w bezpieczniejszym leczeniu bólu i stanów zapalnych u zwierząt towarzyszących.
Początkowo derakoksyb został zatwierdzony do krótkoterminowego leczenia bólu pooperacyjnego po zabiegach ortopedycznych w dawce 3–4 mg/kg doustnie raz dziennie przez maksymalnie 7 dni. W 2003 roku rozszerzono jego wskazania na przewlekłe stosowanie, zatwierdzając dawkę 1–2 mg/kg doustnie raz dziennie w terapii bólu związanego ze zmianami zwyrodnieniowymi stawów.
W badaniach in vitro przeprowadzonych z użyciem testu na pełnej krwi psów, derakoksyb wykazywał wysoki stopień selektywności wobec COX-2. Współczynnik IC₅₀ (COX-1:COX-2) wynosił 48,5, co lokuje go wyżej pod względem selektywności niż inne NPLZ jak meloksykam (7,3) i nimesulid (29,2), choć niżej niż robenakoksyb (128,8). Analogiczne badania przeprowadzone u kotów również potwierdziły przewagę robenakoksybu (32,2) nad meloksykamem (2,7) oraz diklofenakiem (3,9), wskazując na wyraźną różnicę w selektywności w zależności od cząsteczki oraz gatunku zwierzęcia.
Profil farmakokinetyczny derakoksybu różni się znacząco w zależności od gatunku. U psów okres półtrwania (czas, w którym stężenie leku zmniejsza się o połowę) po podaniu doustnym wynosi ok. 3 godzin, natomiast u kotów i koni jest istotnie dłuższy – odpowiednio 7,9 h i 12 h. Sugeruje się, że różnice te mogą wynikać z niższej aktywności enzymów wątrobowych odpowiedzialnych za metabolizm leku u kotów i koni, co prowadzi do łatwiejszego ich nasycenia oraz wydłużenia okresu eliminacji.
W badaniu przeprowadzonym w naszej Katedrze na owcach i kozach, którym podano jednorazowo 150 mg derakoksybu doustnie, zaobserwowano bardzo zbliżony profil farmakokinetyczny (Ryc.3). Okres półtrwania wynosił średnio 16,66 h u owiec oraz 22,86 h u kóz, co wskazuje na znacznie wolniejsze tempo eliminacji leku w porównaniu do psów, a także dłuższy czas ekspozycji na substancję czynną.
Warto podkreślić dużą zmienność międzyosobniczą w zakresie okresu półtrwania leku u badanych małych przeżuwaczy, mimo że wszystkie osobniki były w tym samym wieku i tej samej płci. Zjawisko to jest zgodne z wcześniejszymi obserwacjami u innych gatunków, takich jak psy i koty, i może być związane z indywidualnymi różnicami w metabolizmie wątrobowym. U gęsi, u których okres półtrwania wynosił 6,3 godziny, farmakokinetyka również różniła się istotnie od przeżuwaczy, co może wynikać z odmiennych warunków trawiennych, takich jak pH żołądka, czas pasażu jelitowego i miejsce wchłaniania.
W odniesieniu do badań skuteczności przeciwbólowej in vitro z użyciem psiej krwi gdzie wykazano, że derakoksyb osiąga 50% inhibicji COX-2 (IC₅₀) przy stężeniu 0,16 μg/mL, a 80% (IC₈₀) przy stężeniu 0,39 μg/mL. W naszym modelu owiec i kóz poziom leku utrzymywał się powyżej wartości IC₅₀ przez co najmniej 10 godzin, choć nie osiągał wartości IC₈₀. Sugeruje to, że zastosowana dawka może być wystarczająca do częściowego działania terapeutycznego, jednak dla pełnej skuteczności może być konieczna optymalizacja dawkowania.
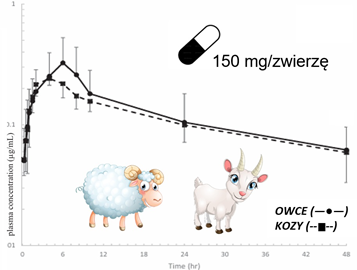
Ryc.3. Krzywe półlogarytmiczne średnich stężeń derakoksybu w osoczu (±SD) w zależności od czasu po: jednorazowej dawce doustnej u owiec (—●—) i (– –) u kóz.
.
Robenakoksyb jest selektywnym COX-2, opracowanym wyłącznie do stosowania w medycynie weterynaryjnej. Jako jedyny koksyb zatwierdzony dla kotów, dostępny jest zarówno w formie tabletek, jak i iniekcji. Zastosowanie tego leku w leczeniu bólu ostrego i przewlekłego u psów oraz kotów stanowi istotny krok w kierunku poprawy bezpieczeństwa terapii przeciwzapalnej u zwierząt towarzyszących.
W badaniu in vitro z wykorzystaniem pełnej krwi psa, robenakoksyb wykazywał najwyższy stopień selektywności wobec COX-2 spośród analizowanych niesteroidowych leków przeciwzapalnych. Stosunek IC₅₀ (COX-1:COX-2) wynosił 128,8, podczas gdy dla innych NLPZ jak: derakoksybu, nimesulidu i meloksykamu wartości te wynosiły odpowiednio 48,5, 29,2 i 7,3. U kotów również potwierdzono wyraźnie wyższy poziom selektywności (32,2) w porównaniu do diklofenaku (3,9) oraz meloksykamu (2,7), co może częściowo tłumaczyć korzystny profil bezpieczeństwa tego leku u przedstawicieli tego gatunku.
Robenakoksyb wykazuje dobrą biodostępność (część substancji czynnej, która z podanej dawki dostaje się do krążenia ogólnego oraz szybkość tego procesu) u psów po podaniu doustnym (84%) i podskórnym (88%). Mimo krótkiego okresu półtrwania we krwi (około 1 godziny), utrzymuje się on dłużej w zapalnie zmienionych tkankach, co wynika m.in. z jego słabo kwasowego charakteru oraz wysokiego stopnia wiązania z białkami osocza. W środowisku zapalnym, w którym dochodzi do obniżenia pH oraz wzrostu perfuzji, obserwuje się sprzyjającą akumulację leku – zjawisko określane jako „pułapka jonowa” (ion-trapping), zwiększające stężenie leku wewnątrz komórek i wydłużające jego działanie miejscowe.
W kontrolowanych badaniach klinicznych wykazano, że u psów robenakoksyb był równie skuteczny co meloksykam w redukcji bólu i stanu zapalnego w okresie okołooperacyjnym. W przypadku kotów, podskórne podanie dawki 2 mg/kg po owariohisterektomii zapewniało skuteczniejsze działanie przeciwbólowe przez okres do 24 godzin w porównaniu do buprenorfiny.
Robenakoksyb charakteryzuje się szerokim marginesem bezpieczeństwa zarówno u psów, jak i u kotów. U młodych kotów nie obserwowano działań niepożądanych nawet po podaniu dawek do 10 mg/kg dziennie przez 28 dni oraz 20 mg/kg przez 42 dni. U psów tolerowano dawki rzędu 40 mg/kg dziennie przez miesiąc oraz 10 mg/kg przez pół roku bez istotnych efektów toksycznych. Tak korzystny profil bezpieczeństwa przypisuje się wysokiej selektywności wobec COX-2, szybkiemu klirensowi ogólnoustrojowemu oraz zdolności do długotrwałej obecności leku w ogniskach zapalnych.
W badaniach przeprowadzonych w naszej Katedrze oceniono farmakokinetykę robenakoksybu u kóz i owiec po jednorazowym podaniu dożylnym (IV, 2 mg/kg) oraz pozanaczyniowym – podskórnym (SC) i doustnym (PO), w dawkach 4 mg/kg.
U kóz stężenia leku w osoczu były wykrywalne do 2 godzin po podaniu IV oraz do 6 godzin po podaniu SC i PO (Ryc.4). Obie drogi pozanaczyniowe wykazały klasyczny efekt flip-flop – wchłanianie było wolniejsze niż eliminacja. Biodostępność wynosiła 98% (po podaniu SC) i 91% (po podaniu PO), przy objętości dystrybucji 246 ml/kg i klirensie 522 ml/h/kg. Maksymalne stężenia osiągano odpowiednio po 1,33 h (SC; 2,34 µg/ml) i 0,51 h (PO; 3,34 µg/ml).
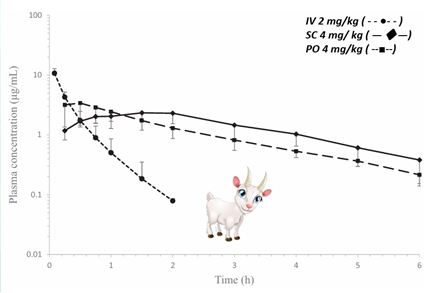
Ryc. 4. Krzywe stężeń robenakoksybu w osoczu (±SD) u kóz po podaniu IV, SC i PO.
.
W przypadku owiec, po IV okres półtrwania końcowej fazy eliminacji wynosił 2,64 h, objętość dystrybucji 0,077 l/kg, a klirens całkowity 0,056 l/h/kg. Po podaniu SC i PO średnie maksymalne stężenia wynosiły odpowiednio 7,04 i 3,01 µg/ml (Ryc.5). Biodostępność tych dróg była niższa niż u kóz: 45,98% (SC) i 16,58% (PO).
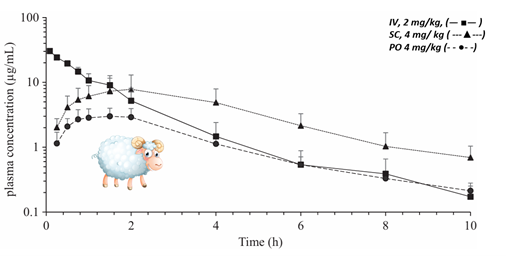
Ryc. 5. Krzywe stężeń robenakoksybu w osoczu (±SD) u owiec po podaniu IV, SC i PO.
.
Podsumowując, wyniki dotyczące podania dożylnego sugerują, że robenakoksyb może nie być optymalnym wyborem terapeutycznym u kóz z uwagi na krótki biologiczny okres półtrwania. Alternatywne drogi podania, takie jak podskórna (SC) oraz doustna (PO), wydają się być bardziej odpowiednie. Pomimo obserwowanego krótkiego okresu półtrwania u innych gatunków, doniesienia o przedłużonym czasie utrzymywania się robenakoksybu w tkankach obwodowych zajętych procesem zapalnym, wspierają zasadność stosowania schematu dawkowania raz na dobę. W przypadku natomiast owiec, na podstawie zaobserwowanych wyników, droga podskórna w dawce 4 mg/kg wydaje się być najlepszym wyborem pod względem biodostępności w porównaniu z pojedynczym podaniem PO.
Koksyby oferują weterynarii nowe możliwości leczenia stanów zapalnych i bólu przy jednoczesnym ograniczeniu skutków ubocznych typowych dla starszych preparatów. Dzięki selektywnemu hamowaniu COX-2 omijają one pułapkę działań niepożądanych w tym wrzodów przewodu pokarmowego, która czyha przy nieselektywnym tłumieniu COX-1. W świetle badań, zarówno derakoksyb, jak i robenakoksyb wykazują obiecujący profil farmakokinetyczny u małych przeżuwaczy – z długim okresem półtrwania, umiarkowaną biodostępnością i selektywnością względem COX-2, która może zrewolucjonizować podejście do analgezji w tej grupie zwierząt. Jednakże, przeprowadzone badania wskazują na różnice w farmakokinetyce badanych koksybów, u owiec i kóz, co podkreśla potrzebę indywidualnego podejścia do terapii w zależności od gatunku. Pomimo obiecujących wyników, konieczne są dalsze badania, aby lepiej zrozumieć mechanizmy działania oraz bezpieczeństwo stosowania tych leków u małych przeżuwaczy.
Fot. Beata Łebkowska-Wieruszewska
Beata Łebkowska-Wieruszewska, Artur Burmańczuk, Cristiana Galant
Katedra Farmakologii, Toksykologii i Ochrony Środowiska, Wydział Medycyny Weterynaryjnej, UP w Lublinie
Uniwersytet Przyrodniczy w Lublinie
ul. Akademicka 13, 20-950 Lublin
NIP 712 010 37 75
REGON 000001896
e-Doręczenia: AE:PL-92700-40162-VCRBJ-25
ePUAP: /UP-Lublin/SkrytkaESP
