
Drożdże probiotyczne jako składnik żywności funkcjonalnej. Cykl: “Poznaj świat nauk o żywności”
Definicja probiotyków według Światowej Organizacji Zdrowia (WHO) oraz Organizacji Narodów Zjednoczonych ds. Wyżywienia i Rolnictwa (FAO) głosi, że są to „żywe mikroorganizmy, które podane w odpowiednich ilościach przynoszą korzyści zdrowotne gospodarzowi” [1]. Definicja kojarzy nam się z probiotycznymi bakteriami należącymi do rodzajów m.in.: Lactobacillus (podzielnego na 25 rodzajów wg nowej nomenklatury z 2020 roku), Bifidobacterium, Enterococcus, Streptococcus, Pediococcus. Jednak do grupy tej należą również drożdże z gatunku Saccharomyces cerevisiae var. boulardii [2].
Aby mikroorganizmy probiotyczne były przydatne dla człowieka muszą spełnić kryteria funkcjonalne i technologiczne. Do cechach funkcjonalnych zalicza się: zdolność do wzrostu w temp. 37°C i przetrwania niekorzystnych warunków w układzie pokarmowym człowieka, pozytywny wpływ na regulację mikrobioty jelitowej, interakcję z układami gospodarza, właściwości antypatogenne i bezpieczeństwo. Wybrany szczep musi być również zidentyfikowany gatunkowo. Do cech technologicznych zalicza się możliwość łatwej produkcji dużych ilości biomasy, odporność na zabiegi konserwacyjne (np. liofilizację), wysoką przeżywalność w gotowym produkcie, stabilność genetyczną oraz brak pogorszenia cech organoleptycznych gotowego produktu [3,4].
Historia drożdży probiotycznych sięga początków XX wieku, kiedy to Henri Boulard wyizolował w Indochinach szczep drożdży o właściwościach przeciwbiegunkowych z owoców liczi i mangostanu, który został nazwany Saccharomyces boulardii [5]. Od lat pięćdziesiątych XX wieku jest szeroko stosowany jako komercyjnie dostępny lek na biegunkę na całym świecie. Pozycja taksonomiczna tych drożdży jest dyskusyjna [6], szybki rozwój filogenetyki molekularnej w ostatnich latach doprowadził do zmiany jego klasyfikacji, podobnie jak miało to miejsce w przypadku wielu gatunków drożdży i obecnie jest klasyfikowany jako Saccharomyces cerevisiae var. boulardii, mimo że posiada pewne unikalne właściwości, nie można go uznać za odrębny gatunek [7] lecz odmianę S. cerevisiae, blisko spokrewnioną ze szczepami winiarskimi [8].
Przeprowadzone badania z użyciem S. cerevisiae var. boulardii wykazały efekty pozytywne w leczeniu chorób żołądkowo-jelitowych, takich jak biegunka przenoszona przez żywność i biegunka podróżnych, choroba Leśniowskiego-Crohna i choroba zapalna jelit, zespół jelita drażliwego, ostre zapalenie żołądka i jelit u dorosłych i dzieci, przewlekła biegunka towarzysząca zakażeniom wirusem HIV, a także wywołana przez Clostridium difficile, Vibrio cholerae i inne patogenne enterobakterie [2,9]. Dodatkowo drożdże te mogą zmniejszyć skutki uboczne terapii przeciwko Helicobacter pylori [10].
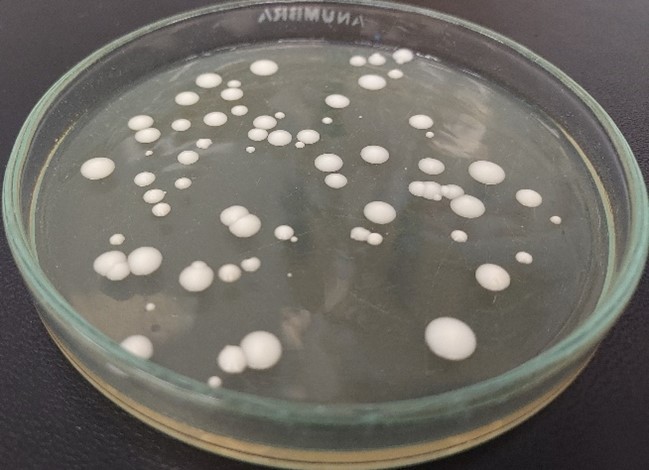
Fot.1: Kolonie drożdży S. cerevisiae var. boulardii CNCM I-745 (Monika Kordowska-Wiater – archiwum prywatne)
 Probiotyki ze względu na swoje właściwości wpływają korzystnie na różne funkcje fizjologiczne, co pozwala na zaliczenie ich jako składnik żywności funkcjonalnej. W ostatnich latach ukazały się liczne badania dotyczące wykorzystania szczepów probiotycznych S. cerevisiae var. boulardii w produkcji środków spożywczych, zwłaszcza w produkcji piwa niskoalkoholowego i bezalkoholowego [11]. Wykazano zdolność gatunku do przetrwania stężenia etanolu występującego w najpopularniejszych rodzajach piw rzemieślniczych [12]. Jako monokultura starterowa służy do wytworzenia piwa rzemieślniczego o wyższej aktywności przeciwutleniającej, niższej zawartości alkoholu, podobnych cechach sensorycznych i wyższej żywotności drożdży niż piwo produkowane przez komercyjne drożdże browarnicze [13]. Inne wyniki pokazują również, że S. cerevisiae var. boulardii w piwie funkcjonalnym po przechowywaniu i tranzycie przez przewód pokarmowy in vitro zachowuje żywe komórki powyżej minimalnej dawki zalecanej ze względu na korzyści zdrowotne [14]. Drożdże probiotyczne można stosować nie tylko do napojów, ale także do różnych innych produktów. Przykładem jest użycie ich jako dodatku wzbogacającego kiełki fasoli (badania były prowadzone w Katedrze Biochemii i Chemii Żywności oraz w Katedrze Biotechnologii, Mikrobiologii i Żywienia Człowieka UP w Lublinie). Dodatek taki nie wpłynął negatywnie na żadne właściwości kiełków, a drożdże znacząco poprawiły jakość mikrobiologiczną produktów końcowych [15]. Z kolei w jogurcie synbiotycznym połączenie drożdży i inuliny zwiększyło ilość korzystnych związków lotnych i poprawiło konsystencję produktu w porównaniu do zwykłego jogurtu kontrolnego [16]. Inna propozycja to połączenie drożdży probiotycznych i kultur starterowych bakterii kwasu mlekowego (LAB) w jogurcie mleka koziego, w którym mikroorganizmy żyły w symbiozie, a liczba drożdży utrzymywała się na stałym poziomie przez cały okres przechowywania [17].
Probiotyki ze względu na swoje właściwości wpływają korzystnie na różne funkcje fizjologiczne, co pozwala na zaliczenie ich jako składnik żywności funkcjonalnej. W ostatnich latach ukazały się liczne badania dotyczące wykorzystania szczepów probiotycznych S. cerevisiae var. boulardii w produkcji środków spożywczych, zwłaszcza w produkcji piwa niskoalkoholowego i bezalkoholowego [11]. Wykazano zdolność gatunku do przetrwania stężenia etanolu występującego w najpopularniejszych rodzajach piw rzemieślniczych [12]. Jako monokultura starterowa służy do wytworzenia piwa rzemieślniczego o wyższej aktywności przeciwutleniającej, niższej zawartości alkoholu, podobnych cechach sensorycznych i wyższej żywotności drożdży niż piwo produkowane przez komercyjne drożdże browarnicze [13]. Inne wyniki pokazują również, że S. cerevisiae var. boulardii w piwie funkcjonalnym po przechowywaniu i tranzycie przez przewód pokarmowy in vitro zachowuje żywe komórki powyżej minimalnej dawki zalecanej ze względu na korzyści zdrowotne [14]. Drożdże probiotyczne można stosować nie tylko do napojów, ale także do różnych innych produktów. Przykładem jest użycie ich jako dodatku wzbogacającego kiełki fasoli (badania były prowadzone w Katedrze Biochemii i Chemii Żywności oraz w Katedrze Biotechnologii, Mikrobiologii i Żywienia Człowieka UP w Lublinie). Dodatek taki nie wpłynął negatywnie na żadne właściwości kiełków, a drożdże znacząco poprawiły jakość mikrobiologiczną produktów końcowych [15]. Z kolei w jogurcie synbiotycznym połączenie drożdży i inuliny zwiększyło ilość korzystnych związków lotnych i poprawiło konsystencję produktu w porównaniu do zwykłego jogurtu kontrolnego [16]. Inna propozycja to połączenie drożdży probiotycznych i kultur starterowych bakterii kwasu mlekowego (LAB) w jogurcie mleka koziego, w którym mikroorganizmy żyły w symbiozie, a liczba drożdży utrzymywała się na stałym poziomie przez cały okres przechowywania [17].
W ostatnich latach wzrasta zainteresowanie tematyką drożdży o potencjalnie probiotycznych właściwościach. Nowe gatunki i szczepy izolowano z różnorodnych produktów i środowisk, takich jak owoce i warzywa, sfermentowana żywność i napoje, odpady przemysłu mleczarskiego itp. Nowe izolaty muszą posiadać wszystkie właściwości wymagane dla probiotyków, spełniać wymogi bezpieczeństwa i mieć dobre właściwości produkcyjne. Izolacja różnych gatunków z licznych środowisk pozwala na odkrycie nowych szczepów probiotycznych o innowacyjnych właściwościach biochemicznych, np. zdolności do wydzielania zewnątrzkomórkowej laktazy, która może nadawać dodatkową zdolność do trawienia serwatki stosowanej jako dodatek w paszach dla zwierząt. Europejski Urząd ds. Bezpieczeństwa Żywności (EFSA) przyznał status QPS (kwalifikowane domniemanie bezpieczeństwa) jedynie nielicznym drożdżom akceptowanym jako „dodatek do żywności”, takim jak: Kluyveromyces marxianus var. lactis i K. marxianus var. fragilis [18]. Poniżej przedstawiono kilka przykładów drożdży innych niż Saccharomyces o wykazanym potencjale probiotycznym. Szczepy drożdży Debaryomyces hansenii uzyskane z jelit ryb i sera charakteryzowały się wyjątkową zdolnością do przetrwania stresów żołądkowo-jelitowych, przylegania do komórek Caco-2 i mucyny oraz silniejszym niż S. cerevisiae var. boulardii, działaniem przeciwzapalnym na ludzkie komórki dendrytyczne [19]. Drożdże Pichia guilliermondii i Candida norvegica, wyizolowane z fermentowanych oliwek stołowych, były odporne na symulowane warunki trawienne na podobnym poziomie jak szczep referencyjny S. cerevisiae var. boulardii [20]. Dwa szczepy Schizosaccharomyces. pombe wykazały dużą zdolność do rozwoju w jelicie żywiciela oraz wysoką aktywność przeciwutleniającą [21]. W innych badaniach wykazano, że drożdże Hanseniaspora osmophila i Pichia kudriavzevii były najbardziej obiecującymi szczepami na podstawie analiz statystycznych stosowanych na każdym etapie selekcji [22]. W badaniach prowadzonych w Katedrze Biotechnologii, Mikrobiologii i Żywienia Człowieka wyizolowano szczepy drożdży z win spontanicznej fermentacji, które zostały przebadane pod kątem potencjalnej probiotyczności i wyłoniono izolaty należące do gatunków: Saccharomyces cerevisiae, Hanseniaspora uvarum i Metschnikowia pulcherrima, które spełniły podstawowe kryteria probiotyczności i będą badane ich właściwości technologiczne [23]. Wykorzystanie drożdży probiotycznych i potencjalnie probiotycznych do produkcji żywności funkcjonalnej pokazuje tabela 1 [24]. Wszyscy naukowcy podkreślają, że potrzebne są dalsze badania w celu ostatecznej selekcji oraz ustalenie statusu GRAS dla wybranych szczepów.
Tabela 1. Probiotyczne i potencjalnie probiotyczne szczepy drożdży w produkcji żywności funkcjonalnej [24].
| Szczep | Produkt | Wartość dodana |
| Pichia fermentans BY5 | Product mleczny | Redukcja cholesterolu |
|
Pichia kudriavzevii BY10 Pichia kudriavzevii BY15 |
Product mleczny j.w. |
Redukcja cholesterolu j.w. |
| Meyerozyma caribbica 9D |
Fermentowany napój ananasowy |
Lepsze właściwości sensoryczne, niższa zawartość etanolu |
|
Saccharomyces cerevisiae var. boulardii Saccharomyces cerevisiae var. boulardii (z Biopron Forte) |
piwo kraftowe piwo niskoalkoholowe i bezalkoholowe |
Piwo funkcjonalne z normalną zawartością etanolu Napoje o cechach piwa, lecz niska zawartość etanolu lub bez etanolu |
| Yarrowia lipolytica HY4 | Product mleczny | Redukcja cholesterolu |
Autorzy:
dr hab. Monika Kordowska-Wiater, prof. UP
mgr inż. Adam Staniszewski Katedra Biotechnologii, Mikrobiologii i Żywienia Człowieka
Literatura
-
Hill, C.; Guarner, F.; Reid, G.; Gibson, G.R.; Merenstein, D.J.; Pot, B.; Morelli, L.; Canani, R.B.; Flint, H.J.; Salminen, S.; et al. Expert consensus document: The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic. Rev. Gastroenterol. Hepatol. 2014, 11, 506–514, doi:10.1038/nrgastro.2014.66.
-
Czerucka, D.; Piche, T.; Rampal, P. Review article: Yeast as probiotics – Saccharomyces boulardii. Aliment. Pharmacol. Ther. 2007, 26, 767–778.
-
Libudzisz, Z. Probiotics and prebiotics in fermented milks. Pediatr. Współczesna 2002, 4, 19–25.
-
Jach, M.; Los, R.; Maj, M.; Malm, A. Probiotyki – aspekty funkcjonalne i technologiczne. Postępy Mikrobiol. 2013, 52.
-
McFarland, L. V. Systematic review and meta-analysis of Saccharomyces boulardii in adult patients. World J. Gastroenterol. 2010, 16, 2202–2222.
-
Altmann, M. The Benefits of Saccharomyces boulardii. In The Yeast Role in Medical Applications; InTech: London, UK, 2017.
-
Edwards-Ingram, L.; Gitsham, P.; Burton, N.; Warhurst, G.; Clarke, I.; Hoyle, D.; Oliver, S.G.; Stateva, L. Genotypic and physiological characterization of Saccharomyces boulardii, the probiotic strain of Saccharomyces cerevisiae. Appl. Environ. Microbiol. 2007, 73, 2458–2467, doi:10.1128/AEM.02201-06.
-
Index Fungorum – Names Record. Available online: http://www.indexfungorum.org/Names/NamesRecord.asp?RecordID=4564
-
Profir, A.-G.; Buruiana, C.-T.; Vizireanu, C. Effects of S. cerevisiae var. Boulardii in Gastrointestinal Disorders. J. Agroaliment. Process. Technol. 2015, 21, 148–155.
-
Yang, L.; Tian, Z.B.; Yu, Y.N.; Zhang, C.P.; Li, X.Y.; Mao, T.; Jing, X.; Zhao, W.J.; Ding, X.L.; Yang, R.M.; et al. Saccharomyces boulardii administration can inhibit the formation of gastric lymphoid follicles induced by Helicobacter suis infection. Dis. 2017, 75.
-
Senkarcinova, B.; Graça Dias, I.A.; Nespor, J.; Branyik, T. Probiotic alcohol-free beer made with Saccharomyces cerevisiae var. boulardii. LWT 2019, 100, 362–367.
-
Ramírez-Cota, G.Y.; López-Villegas, E.O.; Jiménez-Aparicio, A.R.; Hernández-Sánchez, H. Modeling the Ethanol Tolerance of the Probiotic Yeast Saccharomyces cerevisiae var. boulardii CNCM I-745 for its Possible Use in a Functional Beer. Probiotics Antimicrob. Proteins 2021, 13, 187–194.
-
Mulero-Cerezo, J.; Briz-Redón, Á.; Serrano-Aroca, Á. Saccharomyces Cerevisiae Var. Boulardii: Valuable Probiotic Starter for Craft Beer Production. Appl. Sci. 2019, 9, 3250.
-
Pereira de Paula, B.; de Souza Lago, H.; Firmino, L.; Fernandes Lemos Júnior, W.J.; Ferreira Dutra Corrêa, M.; Fioravante Guerra, A.; Signori Pereira, K.; Zarur Coelho, M.A. Technological features of Saccharomyces cerevisiae var. boulardii for potential probiotic wheat beer development. LWT 2021, 135, 110233.
-
Świeca, M.; Kordowska-Wiater, M.; Pytka, M.; Gawlik-Dziki, U.; Seczyk, L.; Złotek, U.; Kapusta, I. Nutritional and pro-health quality of lentil and adzuki bean sprouts enriched with probiotic yeast Saccharomyces cerevisiae var. boulardii. LWT 2019, 100, 220–226.
-
Sarwar, A.; Aziz, T.; Al-Dalali, S.; Zhao, X.; Zhang, J.; Ud Din, J.; Chen, C.; Cao, Y.; Yang, Z. Physicochemical and microbiological properties of synbiotic yogurt made with probiotic yeast saccharomyces boulardii in combination with inulin. Foods 2019, 8, 468.
-
Karaolis, C.; Botsaris, G.; Pantelides, I.; Tsaltas, D. Potential application of Saccharomyces boulardii as a probiotic in goat’s yoghurt: Survival and organoleptic effects. J. Food Sci. Technol. 2013, 48, 1445–1452.
-
Arévalo-Villena, M.; Fernandez-Pacheco, P.; Castillo, N.; Bevilacqua, A.; Briones Pérez, A. Probiotic capability in yeasts: Set-up of a screening method. LWT 2018, 89, 657–665.
-
Ochangco, H.S.; Gamero, A.; Smith, I.M.; Christensen, J.E.; Jespersen, L.; Arneborg, N. In vitro investigation of Debaryomyces hansenii strains for potential probiotic properties. World J. Microbiol. Biotechnol. 2016, 32.
-
Oliveira, T.; Ramalhosa, E.; Nunes, L.; Pereira, J.A.; Colla, E.; Pereira, E.L. Probiotic potential of indigenous yeasts isolated during the fermentation of table olives from Northeast of Portugal. Food Sci. Emerg. Technol. 2017, 44, 167–172.
-
Gil-Rodríguez, A.M.; Carrascosa, A.V.; Requena, T. Yeasts in foods and beverages: In vitro characterisation of probiotic traits. LWT Food Sci. Technol. 2015, 64, 1156–1162.
-
Fernandez-Pacheco Rodríguez, P.; Arévalo-Villena, M.; Rosa, I.Z.; Briones Pérez, A. Selection of potential non-Sacharomyces probiotic yeasts from food origin by a step-by-step approach. Food Res. Int. 2018, 112, 143–151.
-
Staniszewski, A.; Kordowska-Wiater, M. Probiotic Yeasts and How to Find Them—Polish Wines of Spontaneous Fermentation as Source for Potentially Probiotic Yeasts. Foods 2023, 12, 3392. https://doi.org/ 10.3390/foods12183392
-
Staniszewski, A.; Kordowska-Wiater, M. Probiotic and Potentially Probiotic Yeasts— Characteristics and Food Application. Foods 2021, 10, 1306. https://doi.org/ 10.3390/foods10061306
Uniwersytet Przyrodniczy w Lublinie
ul. Akademicka 13, 20-950 Lublin
NIP 712 010 37 75
REGON 000001896
ePUAP: /UP-Lublin/SkrytkaESP
