
Mykobakteriozy to choroby wywołane przez prątki kwasooporne inne niż prątki gatunku Mycobacterium tuberculosis complex (MTBC) i Mycobacterium leprae. Prątki te określane są jako niegruźlicze (ang. nontuberculosis mycobacteria NTM), MOTT (ang. mycobacteria other than tuberculosis) lub nazywane są również atypowymi (Siemion-Szcześniak i Wyrostkiewicz 2016). Mykobakterie łączą w sobie cechy bakterii i grzybów. Biologicznie są spokrewnione z promieniowcami (Actinomyces) i maczugowcami (Corynebacterium).
Charakterystyczną cechą prątków kwasoodpornych jest odmienna niż u innych bakterii budowa ściany komórkowej, w skład której wchodzą lipidy (~60% suchej masy), znaczny odsetek wosków (4-25%). Dzięki temu ściana ma charakter hydrofobowy co sprawia, że jest ona nieprzepuszczalna dla stosowanych w wielu metodach barwienia anilinowych barwników zasadowych. Specyficzna budowa prątków daje im dużą kwasooporność oraz oporność na czynniki takie jak wysuszenie, niskie i wysokie pH, wysoką i niską temperaturę. Stanowią one barierę mechaniczną przed działaniem czynników środowiska zewnętrznego i środków dezynfekcyjnych. Po części uniemożliwiają także skuteczne wiązanie do struktur komórki bakteryjnej cząstek leków. W oparciu o właściwości fenotypowe na podłożu hodowlanym, prątki MOTT można również podzielić na wolno rosnące prątki (ang. slowly growing mycobacteria SGM) oraz szybko rosnące prątki (ang. rapidly growing mycobacteria RGM) (Runyon 1965).
Diagnostyka laboratoryjna – Badanie hodowlane
Materiałem do badań w kierunku mykobakteriozy może być tkanka pobrana przyżyciowo (Ryc. 1; Krajewska 2019), jak i pośmiertnie (Ryc.2; Krajewska 2015). Rozdrobnioną tkankę wraz z kwasem szczawiowym 5% umieszczamy w specjalnych woreczkach i homogenizujemy w aparacie typu stomacher. Następnie zawartość woreczka przelewano do probówki typu Falcon i odstawiano do cieplarki na 20 minut. Po tym czasie próbkę wirowano przez 10 min. przy 3000-4000 obr/min. Supernatant usuwano, a osad przemywano dwukrotnie jałowym płynem fizjologicznym. Tak uzyskany osad wykorzystywano bezpośrednio do posiewu na podłoża lub do wykonania preparatu bakterioskopowego. Podłoża stałe wykorzystywane w diagnostyce laboratoryjnej mykobakterioz to: Lowenstein-Jensen (L-J). Petragnani (P) oraz Stonenbrinck (S). Posiewy należy inkubować w cieplarce, w temperaturze 37°C (+/- 2°C), przez okres 4 tygodni.
Badanie mikroskopowe
Po wysuszeniu świeżo sporządzonego preparatu mikroskopowego utrwalamy go nad płomieniem palnika, a następnie barwimy wg metody Ziehl-Neelsena (ZN). W pierwszym etapie preparat pokrywamy roztworem fuksyny karbolowej i podgrzewamy płomieniem palnika aż do ukazania się pary. Czynność powtarzamy dwukrotnie w czasie 5 minut. Po ostudzeniu preparat płukamy wodą destylowaną i zalewano 3% kwasem solnym w etanolu, na około 2 minuty. Ponownie płukamy preparat wodą destylowaną a następnie dobarwiamy barwnikiem kontrastowym przez około 20-30 sekund. Wypłukany wodą destylowaną preparat i wysuszony w temperaturze pokojowej, należy oglądać pod imersją w powiększeniu 100x, w co najmniej 50 polach widzenia (Ryc. 3; Krajewska 2024).
Typowanie genetyczne
Oznaczenie gatunku wyhodowanych mycobacterii (Ryc. 4; Krajewska 2024) należy przeprowadzić za pomocą testów do identyfikacji gatunkowej – Hain Lifesciences® (Nehren, Germany). Dobrze ugruntowane testy molekularne GenoType Mycobacterium CM VER 2.0 i GenoType Mycobacterium AS VER 1.0 umożliwiają wiarygodne różnicowanie między kompleksem M. tuberculosis a gatunkami NTM z materiału hodowlanego. Test GenoType Mycobacterium CM VER 2.0 wykrywa kompleks M. tuberculosis i różnicuje szeroki zakres klinicznie istotnych NTM w jednym teście. GenoType Mycobacterium AS VER 1.0 uzupełnia diagnostykę o dodatkowe gatunki NTM z tego samego przygotowania próbki. Razem oba testy obejmują kompleksowy panel najczęściej spotykanych i klinicznie istotnych mykobakterii na poziomie gatunku, zapewniając lekarzom informacje niezbędne do podejmowania skutecznych decyzji terapeutycznych. Procedura identyfikacji składa się z trzech etapów: izolacji DNA, amplifikacji przy użyciu primerów znakowanych biotyną i odwrotnej hybrydyzacji.
Pomimo tego, że najbardziej obiektywnym dowodem potwierdzenia gruźlicy u zwierzęcia jest dodatni wynik badania mikrobiologicznego – czyli wyhodowanie prątków gruźlicy na pożywkach, to techniki molekularne stanowią istotne uzupełnienie diagnostyki tej choroby. Włączenie testów genetycznych do identyfikacji prątków zostało w UE usankcjonowane prawnie, zgodnie z Rozporządzeniem Komisji (WE) nr 1226/2002 z dnia 8 lipca 2002r., zmieniające załącznik B do Dyrektywy Rady 64/432/EWG.
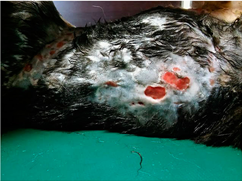
Rycina 1. Mykobakterioza skóry u kota (Krajewska 2019)
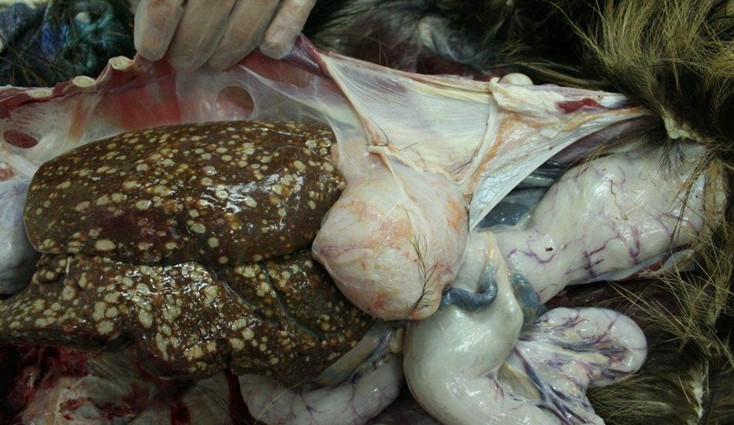
Rycina 2. Krucha, ciemnobrązowa wątroba z licznymi ziarniniakami ropnymi (Krajewska 2015)
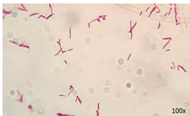
Rycina 3. Kwasooporne prątki w preparacie mikroskopowym (Krajewska 2024)

Rycina 4. Wzrost szybkorosnących prątków (RTM) na podłożu stałym L-J (Krajewska 2024)
Podsumowanie
Mykobakteriozy nie należą do wykazu chorób zakaźnych, tym samym nie podlegają obowiązkowi rejestracji, dlatego dane epizootyczne dotyczące częstości ich występowania są szacunkowe. Z licznych publikacji wynika, że na całym świecie od dziesięcioleci obserwuje się tendencję wzrostową zachorowań na mykobakteriozy zarówno u ludzi, jak i u zwierząt (Puk i Guz 2020; Adjemian i wsp. 2018 ). Wpływ na tę sytuację ma m. in. postęp w diagnostyce laboratoryjnej, w tym rozwój badań molekularnych umożliwiających określenie gatunku prątków. Mykobakteriozy są potencjalną chorobą odzwierzęcą dla ludzi (Martinho i Heatley 2012; Delghandi i wsp. 2020; Fukano i wsp. 2021).
Czynnikiem etiologicznym mykobakterioz może być ponad 200 gatunków prątków, dlatego celowo użyto liczby mnogiej – mykobakteriozy. Błędem jest nazywanie mykobakteriozy gruźlicą.
Piśmiennictwo
Adjemian J., Daniel-Wayman S., Ricotta E., Prevots D.R.: Epidemiology of Nontuberculous Mycobacteriosis. Semin Respir Crit Care Med. 2018; 39(3); 325-335.
Delghandi M.R., El-Matbouli M., Menanteau-Ledouble S.: Mycobacteriosis and Infections with Non-tuberculous Mycobacteria in Aquatic Organisms: A Review. Microorganisms. 2020 ;8(9); 1368.
Fukano H., Terazono T., Hirabayashi A., Yoshida M., Suzuki M., Wada S., Ishii N., Hoshino Y.: Human pathogenic Mycobacterium kansasii (former subtype I) with zoonotic potential isolated from a diseased indoor pet cat, Japan. Emerg Microbes Infect. 2021; 10(1); 220-222.
Krajewska M., Czujkowska A., Weiner M., Lipiec M., Szulowski K.: Avian tuberculosis in a captive cassowary (Casuarius casuarius). Bull Vet Inst Pulawy 2015; 59; 483-487.
Krajewska-Wędzina M., Czujkowska A., Kozińska M., Bochniarz M., Tracz A., Hahaj-Siembida A., Osińska M., Trościańczyk A. Nowakiewicz A.: Mycolicibacterium fortuitum (Mycobacterium fortuitum) complex infection in a captive Soccoro dove (Zenaida graysoni). Med. Weter. 2024; 80 (10); 543-546.
Krajewska-Wędzina, M., Dąbrowska, A., Augustynowicz-Kopeć, E., Weiner, M., Szulowski, K.:: Nontuberculous mycobacterial skin disease in cat; diagnosis and treatment – Case report. Ann Agric Environ Med. 2019; 26(3); 511-513.
Martinho F., Heatley J.J.:: Amphibian mycobacteriosis. Vet Clin North Am Exot Anim Pract. 2012; 15(1) 113-119.
Puk K, Guz L.: Occurrence of Mycobacterium spp. in ornamental fish. Ann Agric Environ Med. 2020; 27(4); 535-539.
Runyon EH. Typical mycobacteria. Their classification. Am J Respir Dis. 1965; 91; 288–294.
Siemion-Szcześniak I., Wyrostkiewicz D.: Mykobakteriozy – rozpoznawanie i leczenie. Postępy Nauk Medycznych 1/2016, 49-55
Uniwersytet Przyrodniczy w Lublinie
ul. Akademicka 13, 20-950 Lublin
NIP 712 010 37 75
REGON 000001896
e-Doręczenia: AE:PL-92700-40162-VCRBJ-25
ePUAP: /UP-Lublin/SkrytkaESP
